Seitenpfad:
- Allg./Marine Geologie
- Gashydrat-Forschung
- Struktur und Stabilität
Struktur und Stabilität
Gashydrate sind nicht-stöchiometrische Verbindungen, in denen die Wassermoleküle (sogenannte Strukturmoleküle) Käfigstrukturen aufbauen, und Gasmoleküle (als Gastmoleküle) einschließen. Sie werden deshalb auch Einschlussverbindungen oder Clathrate (lat.: clathratus = Käfig) genannt. Generell können Gashydrate bei ihrer Bildung gleichzeitig verschiedene Gasmoleküle, abhängig von ihrer Häufigkeit in der Umgebung, in getrennten Käfigen einbauen. In der Natur sind es neben CH4 und C2H6 vor allem H2S, CO2 und seltener höhere Kohlenwasserstoffe.
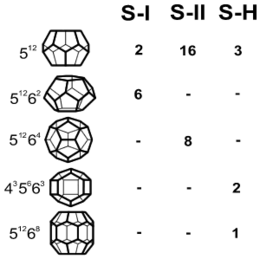
Bild:
Die drei bisher bekannten Gashydratstrukturen I, II und H werden aus einer unterschiedlichen Zahl der fünf dargestellten Käfigtypen aufgebaut. Einfachster Käfigtyp ist ein Pentagondodekaeder (5 12) der in allen drei Gashydratstrukturen zu finden ist, während die anderen Käfigtypen jeweils nur in einer Gashydratstruktur vertreten sind.
Die drei bisher bekannten Gashydratstrukturen I, II und H werden aus einer unterschiedlichen Zahl der fünf dargestellten Käfigtypen aufgebaut. Einfachster Käfigtyp ist ein Pentagondodekaeder (5 12) der in allen drei Gashydratstrukturen zu finden ist, während die anderen Käfigtypen jeweils nur in einer Gashydratstruktur vertreten sind.
Bisher sind drei Kristallstrukturen von Gashydraten bekannt, von denen die beiden Strukturen SI und SII im kubischen und die dritte Struktur (auch H genannt), wie Eis im hexagonalen Kristallsystem kristallisieren. Die Struktur der Gashydrate kann dabei als eine Packung von Polyederkäfigen aufgefasst werden. Alle drei Strukturen kommen in der Natur vor, wobei die Struktur I am häufigsten ist. Sie besteht aus 8 Käfigen zweier Typen in der Elementarzelle. In den Käfigen der Struktur I können Gasmoleküle mit einem Durchmesser kleiner als das Propanmolekül, z.B. CH4, CO2 oder H2S, eingebaut werden. Diese Kristallstruktur ist daher in der Natur vorwiegend an das Vorkommen biogenen Gases gebunden, das z.B. in den Sedimenten der Ozeanböden weit verbreitet ist. Die Struktur II enthält 24 Käfige pro Elementarzelle, 16 kleine Käfige und 8 große Käfige, wobei die letztgenannten Käfige größer sind als die in Struktur I.
Natürliche Gasgemische mit Molekülen größer als Ethan und kleiner als Pentan bilden daher die Struktur II. Ihr Vorkommen ist meist auf Gebiete mit thermogener Gasbildung in Sedimenten beschränkt. Die kompliziertere Struktur H enthält neben kleineren Käfigen auch einen Käfigtypus, der zum Aufbau sehr große Gasmoleküle (z.B. Metylcyclohexan) benötigt.
Natürliche Gasgemische mit Molekülen größer als Ethan und kleiner als Pentan bilden daher die Struktur II. Ihr Vorkommen ist meist auf Gebiete mit thermogener Gasbildung in Sedimenten beschränkt. Die kompliziertere Struktur H enthält neben kleineren Käfigen auch einen Käfigtypus, der zum Aufbau sehr große Gasmoleküle (z.B. Metylcyclohexan) benötigt.

Bild:
Schmelzender Methanhydratbrocken in der Hand. Während das bei der Methanhydratzersetzung frei werdende Methan eine konstante Flamme speist ("Brennendes Eis"), tropft das frei werdende Wasser ab.
Schmelzender Methanhydratbrocken in der Hand. Während das bei der Methanhydratzersetzung frei werdende Methan eine konstante Flamme speist ("Brennendes Eis"), tropft das frei werdende Wasser ab.
Zur Bildung von Gashydrat sind neben der Verfügbarkeit einer ausreichenden Menge von Gas und Wasser die Druck-Temperatur-Bedingungen die entscheidenden Faktoren. Gashydrate sind nur bei hohem Druck und relativ niedriger Temperatur stabil, wobei die Anwesenheit von H2S, CO2 und höheren Kohlenwasserstoffen die Hydrat-Gas-Phasengrenze zu höheren Temperaturen verschiebt. Stickstoff und im Wasser gelöste Salze verschieben die Phasengrenze dagegen zu niedrigeren Temperaturen.


